От редакции: Данной статьей мы начинаем публиковать документы из секретного архива агента ЦРУ, Джона Сиджейка, который был одним из кураторов направления свободной и альтернативной энергии. На первый взгляд может показаться, что данная статься не имеет никакого отношения к свободной энергии. Но мы уверены, что это не так… По этому мы и дальше будем публиковать документы данного архива по порядку. Даже если тематика документов на первый взгляд кажется далекой от основной темы проекта.
Функциональная модель клеточных мембран.
1 страница
Оболочки, окружающие целые клетки, клеточные ядра и различные органоиды, являются тонкими образованиями из жировых и белковых молекул. Их функции зависят от того, каким образом соединены мембранные белки.
Родерик А. Капальди
Фундаментальной составляющей живой ткани является клетка. В последний годы стало известно, что один из клеточных компонентов, а именно клеточная мембрана, играет ключевую роль во всех процессах, происходящих в клетке. Цитоплазматическая мембрана, наружная оболочка, окружающая клетку, регулирует внутреннюю среду клетки и транспортирует вещества, как в клетку, так и из неё. Внутренние мембраны, которые отделяют клеточное ядро от таких органоидов, как микросомы, митохондрии и растительные хлоропласты, играют не менее важную роль. К примеру, в мембране митохондрии образуется аденозинтрифосфат (АТФ); следовательно, эта мембрана обеспечивает энергией все метаболические процессы клетки. Аналогичным образом, мембрана хлоропласта является местом, где происходит фотосинтез — процесс, посредством которого энергия солнца преобразуется в форму пригодную для использования живыми клетками. Каким же образом были созданы клеточные мембраны, выполняющие так много разнообразных задач?
Сейчас существует огромное количество информации, касающейся базовой структуры клеточной мембраны. Одним из фактов, ставших известными в последнее время, является то, что цитоплазматические и внутренние мембраны существенным образом похожи; обе состоят из белков и жирной субстанции, являющейся липидами. В клетках млекопитающих также присутствуют небольшие количества углеводов. Они могут быть объединены с белками, являясь гликопротеинами, т.е. углеводосодержащими белками, или с жирами, являясь гликолипидами.
Практически все клеточные мембраны более чем на 50% состоят из жиров. У внутренних мембран это исключительно фосфолипиды. Цитоплазматические мембраны, напротив, содержат, как гликолипиды, так и нейтральные, свободные жиры, вдобавок к фосфолипидам. К примеру, около 30 процентов жиров в мембране эритроцита состоят из…. (часть текста не видна, страница отсканирована не до конца)
Каждая жировая молекула состоит из «головы» и двух «хвостов» (см. иллюстрацию на следующей странице). В точке, где соединены «головка» и «хвосты», которую К. Фред Фокс из Калифорнийского Университета в Лос-Анджелесе называет корешком, находится глицериновая группа. Хвосты, отходящие от корешка, являются длинными цепями, состоящими из жирных кислот. Строение этих цепей достаточно похоже на строение подобных цепей у молекул нефти, и поскольку нефть и вода, как правило, разделяются на отдельные слои, когда их перемешивают, также и хвосты фосфолипидных молекул обычно отделяются от воды. Этим объясняется их гидрофобия. Головки фосфолипидных молекул напротив растворяются в воде, отчего называются гидрофильными. Молекулы такого рода, с одним гидрофобным и вторым гидрофильным концом, называются амфипатическими. Гликолипиды и в некоторой степени нейтральный жиры тоже амфипатичны.
Жиры в мембранах располагаются таким образом, чтобы примирить свой амфипатический характер. Они образуют два плотно расположенных слоя, так, чтобы их гидрофильный головки образовывали верхушку и нижнюю поверхность, а их гидрофобные хвосты были спрятаны во внутренней части мембраны (см. верхнюю иллюстрацию на странице 29). Двойной слой липидов имеет ширину в 45 ангстрем. Это структурная рама мембраны. Этот слой также является своеобразной опорой для других важных компонентов мембраны: белков.
Протеины и гликопротеины играют разнообразные роли в мембране. Они могут способствовать поддержанию структурной целостности мембраны, к тому же, они являются ферментами и выполняют роль насоса, перемещая вещества внутрь и из клеток или органоидов. Такое разнообразие функций протеинов придаёт каждой мембране свою отдельную отличительную черту.
(часть текста не видна, страница отсканирована не до конца)
, чьи мембраны могут быть определены различными путями. Одним из таких путей является анализ ферментативной деятельности клетки. Вторым путём является идентификация белков по молекулярному весу, используя технику гель — электрофореза. Белки состоят из длинных цепей, построенных из аминокислот, которые называют полипептидами. Некоторые белки имеют только одну полипептидную цепь; другие же имеют множество таких цепей, плотно связанных друг с другом. В подготовке к гель — электрофорезу протеин разделяют на составляющие его полипептидные цепи, повергая его воздействию поверхностно-активного вещества додецилсульфата натрия. Тогда цепи переносят в гель полиакриламида, находящийся под электрическим напряжением. В ответ на напряжение они перемещаются сквозь гель в количестве, пропорциональном их молекулярной массе; чем меньше вес полипептида, тем дальше он двигается. Гель тогда окрашивают специфической белковой субстанцией, к примеру, кумасси бриллиантовым голубым, что позволяет пристально изучить спектральную поглощательную способность. Когда, к примеру, протеины сопоставляют с мембранами эритроцитов таким образом, линия развёртки обнаруживает полипептиды с весом в диапазоне 250 – 12,5 тысяч.
Два самых тяжёлых полипептидных компонента с молекулярным весом 255,000 и 220,000 известны под общим названием спектрин. (Винсент Т. Маршеси из Йельского Медицинского Университета выбрал это название, потому что он впервые отделил компоненты от «призраков», а именно отделил мембраны эритроцитов от гемоглобина). На спектрин приходится около трети всего белка мембраны эритроцита. Ещё треть белка приходится на диффузную полосу поглощения с молекулярным весом около 90,000. Эта полоса содержит ряд различных полипептидов, включая компонент (часть текста не видна, страница отсканирована не до конца)
2 страница
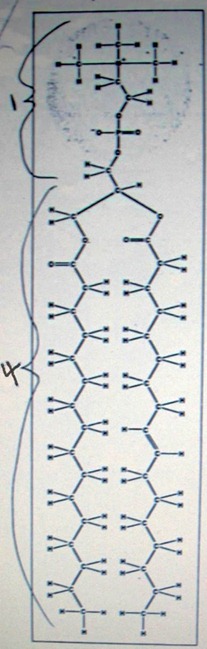
Амфипатическое строение жировой клетки с гидрофильной головкой и двумя одинаковыми гидрофобными хвостами
Картинка: Амфипатическое строение жировой клетки с гидрофильной головкой и двумя одинаковыми гидрофобными хвостами показано на примере типичного фосфолипида – на конкретной молекуле фосфатидилхолина. Различные жировые молекулы составляют третью часть массы мембраны клетки млекопитающего, образуя структурный каркас мембраны. Их хвосты, состоящие из жирных кислот, могут быть насыщенными( слева), с атомами водорода, прикреплёнными к каждому атому углерода, и ненасыщенными (справа), где атомы углерода свободны.
… в равных размерах в каждой молекуле спектрина. Протеины с молекулярным весом ниже 70,000 составляют оставшуюся треть белков в мембране. В мембране эритроцитов может находится необычайно большое количество белков со значительным молекулярным весом. Для сравнения: почти все полипептиды, находящиеся в мембране митохондрии, имеют вес ниже 70,000.
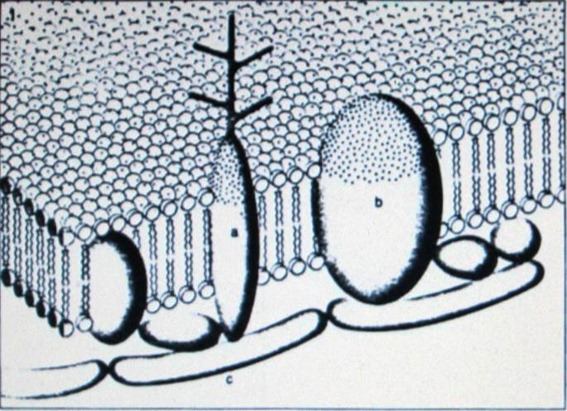
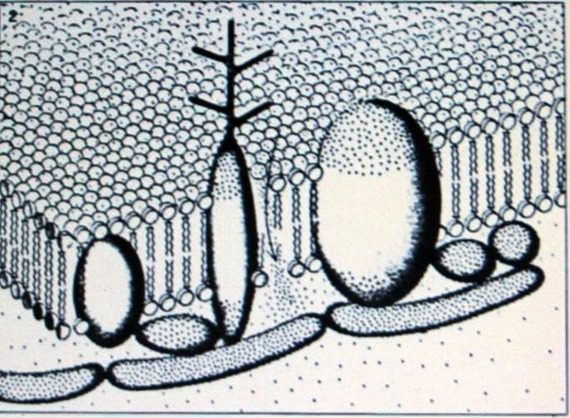
Мембранные белки могут быть разделены на 2 класса в зависимости от их расположения относительно жиров, составляющий каркас мембраны. Первый класс состоит из белковых молекул, которые присоединены к наружной поверхности мембраны. Эти «внешние» белки примыкают, как к внутренней, так и к внешней поверхности мембраны. Второй класс состоит из белков, которые фактически проходят сквозь поверхность мембраны. Эти «внутренние» белки также проникают в двойной слой жиров, некоторые из них полностью его пронзают (см. верхнюю иллюстрацию на противоположной странице). То, к какому классу относится мембранный белок, можно определить на основе его химических качеств, или же на основе других видов анализа, таких как дифракция рентгеновских лучей или электронная микроскопия. К примеру, внешние протеины относительно легче отделить от мембраны путём методов химической диссоциации, тогда как внутренние белки являются неотъемлемой частью мембраны, что значительно усложняет их отделение.
Два внешних белка, которые видны на электронных микроснимках, являются ферментом АТФ, обнаруженным в мембране митохондрии, и спектрином – полипептидом в мембране эритроцита. Объекты, названные «шлемами», при рассматривании в электронный микроскоп выдаются за линию поверхности мембраны митохондрии. Это молекулы АТФ. Точно также, при рассматривании эритроцитов можно увидеть «бородку», состоящую из полипептидов спектрина, на внутренней стороне мембраны.
Родопсин является единственным внутренним белком, который был детально изучен. Этот белок присутствует в мембранах дисков, которые занимают наружные сегменты палочковидных клеток сетчатки. Дж. Кент Блейзи со своими коллегами из Пенсильванского Медицинского Университета, работая по технике дифракции рентгеновских лучей, обнаружили, что молекула родопсина имеет шарообразную форму с диаметром 42 ангстрема. Когда палочки сетчатки находятся в темноте, молекулы родопсина, расположенные на дисковой мембране, погружаются на треть своего диаметра в наружную часть поверхности мембраны. Когда же палочки попадают на свет, молекулы родопсина погружаются в мембрану на 50 процентов. Тем не менее, даже в этом случае молекулы проникают внутрь меньше, чем в двойной слой липидов.
Работая в лаборатории Дэвида Е. Грина в Институте исследований ферментов Университета Висконсина, моим коллегам и мне удалось исследовать строение другого внутреннего белка, а именно цитохромоксидазу, фермента из мембраны митохондрии, который является конечным звеном в цепи переноса электрона, участвуя в синтезе АТФ. Теперь камнем преткновения на тропе изучения мембранных белков является тот факт, что все мембраны содержат неоднородную смесь протеинов, включая внутренние и внешние белки. Практически все методы, которые могут быть использованы в изучении строения мембраны, такие как дифракция рентгеновских лучей, являются привычными методами; полученные данные дают только усреднённые качества всех протеинов образца, тогда как мы ходит получить индивидуальную характеристику всех белков мембраны. Это одна из причин, по которой дисковые мембраны сетчатки с её единственным протеином – родопсином, являются популярным предметом исследований.
К счастью, нам удалось отделить цитохромоксидазу от других белков мембраны митохондрии. Когда отделённый фермент был помещён в суспензию с липидами, жиры и фермент взаимодействовали и скапливались в везикулы (мешковидные пузырьки), которые в действительности представляют собой искусственно созданные мембраны. Молекулы цитохромоксидазы в искусственных везикулах имеют те же ферментные качества, которые демонстрируются ими в нормальной мембране митохондрии, что даёт основания предполагать: везикула имеет то же строение, что и нормальная мембрана. Преимущество состоит в том, что неоднородный состав протеинов был уменьшен до одного единственного белка.
Мы использовали эти мембранные везикулы, как модели для изучения изолированных белков в их геометрических отношениях с двойным слоем липидов. В качестве субстанции переноса электрона цитохромоксидаза может пребывать в двух состояниях: окисленном или восстановлённом. В окисленном состоянии (и в небольшом ряду жиро — протеиновых отношений) энзим образовывает прозрачную сетку, которая видна под электронным микроскопом и может быть исследованы путём дифракции рентгеновских лучей (см. иллюстрацию на странице 26). Используя оба факта, мы обнаружили, что единичные молекулы цитохромоксидазы имеют длину 55 ангстрем, ширину 60 ангстрем и толщину от 80 до 85 ангстрем. Это достаточная толщина, чтобы молекула была способна проникнуть на 45 ангстрем вглубь двойного слоя липидов, оставляя один конец …. (часть текста не видна, страница отсканирована не до конца)
3 страница
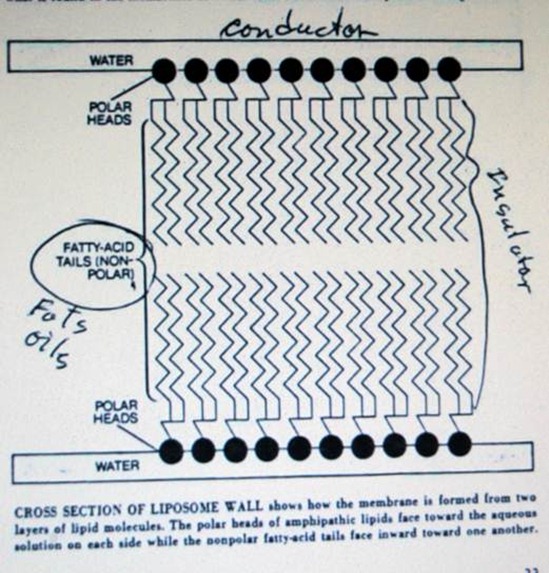
1 картинка – надписи: Внешняя водянистая фаза, Оболочка липосомы, Внутренняя водянистая фаза.
1 картинка – подпись: Искусственно- созданный замкнутый пузырёк, называемый липосомой, создан путём подвергания водянистой суспензии из фосфолипидов воздействию высокоэнергетических звуковых волн. Дифракция рентгеновских лучей показывает, что фосфолипиды в липосоме выстраиваются в упорядоченной последовательности, что похоже на процесс в мембранах настоящих клеток. Область внутри квадратика увеличена ниже.
2 картинка – надписи: Вода, Полярные головки, Хвосты, состоящие из жирных кислот (неполярные), Полярные головки, Вода.
2 картинка – подпись: Сечение липосомной стенки показывает, что мембрана состоит из двух слоёв липидов. Полярные головки амфипатических липидов соприкасаются с водянистым раствором с обеих сторон, в то время, как хвосты, состоящие из жирных кислот, направлены внутрь, друг к другу.
… бактерия Escherichia coli. Таким образом, разница в образовании аминокислот не может являться причиной того, что мембранные белки не растворяются в воде.
Исследование, проведённое Л. Спатцем и Филиппом Стритмэтером из Университета Коннектикута, показывают, что наиболее приемлемым объяснением того, что мембранные протеины не растворяются в воде, является то, каким образом расположены их аминокислоты. Спатц и Стритмэтер подвергли мембраны клеток печени кролика лёгкому воздействию фермента, расщепляющего белок. Данное воздействие привело к отделению биологически активной части мембранного протеина – цитохрома Б3. В отдельной процедуре они растворили и очистили целый цитохром Б3 и подвергли его воздействию фермента, расщепляющего белок. Такое воздействие также высвободило водорастворимую, биологически активную часть молекул с небольшим количеством продуктов распада , которые не растворились в водянистом растворе. Биологически активная часть молекул, которая была получена из мембраны или очищенного белка, оказалась богатой на полярные аминокислоты. А вот фрагменты белков, которые не растворились в воде, напротив, были богаты на неполярные аминокислоты. Эти наблюдения говорят о том, что огромное количество мембранных белков могут быть амфипатичными, обладая неполярным участком, который находится в той части мембраны, где расположены неполярные фосфолипидные хвосты, состоящие из жирных кислот, и полярный участок, который находится на поверхности мембраны.
Сейчас мы подошли к вопросу о том, как же вещества проходят через мембраны? Неполярный участок из жирно- кислотных хвостов двойного слоя фосфолипидов физически несовместим с такими малыми по весу растворимыми веществами, как ионы метала, сахароза и аминокислоты. Таким образом, фосфолипидный слой является барьером, препятствующим их свободному передвижению. Если измерить скорость, с которой глюкоза проходит через фосфолипидную стенку липосомы, она окажется невероятно малой по сравнению со скоростью, с которой глюкоза проходит сквозь биологические мембраны. Информация такого рода стала основанием для появления идеи о том, что самостоятельные образования названные «транспортёрами» скорее всего присутствуют в мембранах для того, чтобы способствовать более простому переходу ионов металла и небольших полярных молекул сквозь барьер, состоящий из двойного слоя фосфолипидов.
Эксперименты с биологическими мембранами показывают, что гипотетические «транспортёры» высоко избирательны. К примеру, «транспортёры», обычно проводящие сквозь слой липидов глюкозу, ни в коем случае не поспособствуют переходу аминокислот или других сахаров. Интересный экспериментальный …. (часть текста не видна, страница отсканирована не до конца)
4 страница
Надпись под картинками: Ассиметричное расположение молекул белков, объединённых с мембранами эритроцитов, демонстрируется путём маркировки белков. Когда химический реагент, не способный преодолеть барьер из двойного слоя жиров, касается к поверхности клетки (1), только два проникающих белка с концами, которые оказываются за пределами поверхности клетки (а, в), маркируются. Когда добавляется лизирующий агент, который проделывает брешь в мембране, маркируются все молекулы на мембране и на другой стороне, включая спектрин (с), который, скорее всего, и удерживает их на месте.
… белки с внутренней части мембраны митохондрии с молекулярным весом 10,000. В нём содержится 20 процентов гидрофильных и 80 процентов гидрофобных аминокислот. Это достаточно сильно контрастирует с белками цитоплазматической и внешней мембран, которые в среднем состоят из 47 процентов гидрофильных и 53 процентов гидрофобных аминокислот. Другим очень гидрофобным внешним белком является белок Фолча – Лиза, который может быть отделён от миелиновой оболочки седалищного нерва. Его аминокислоты на 27 процентов гидрофильны и на 83 процента гидрофобны. Внешние протеины родопсин и цитохромоксидаза гидрофильны; аминокислоты родопсина на 36 процентов гидрофильны и на 64 процента гидрофобны, а вот аминокислоты цитохромоксидазы на 37 процентов гидрофильны и на 63 процента гидрофобны.
В последнее время были охарактеризованы два интересных внешних белка. Хотя они и не чрезмерно гидрофобны по общему составу, в их состав входят участки полипептидных цепей, которые очень богаты на гидрофобные аминокислоты. Одним из них является цитохром Б3, белок, отделённый от микросомальной мембраны клеток печени. Филипп Стритмэтер и Лоуренс Спатц из Университета Коннектикута доказали, что этот протеин является одиночным полипептидом, который с одной стороны шарообразно изогнут, выходя за поверхность мембраны. Он преимущественно покрыт гидрофильными аминокислотами. Полипептидная цепь тянется за пределы шарообразного изгиба, переходя в «хвост» из более чем 60 аминокислот, большинство из которых гидрофобны. Хвост проникает вглубь двойного слоя жиров и служит фиксатором сферического ферментативно активного участка молекулы по отношению к мембране.
Вторым внешним протеином с необычным строением является основной гликопротеин, обнаруженный в мембране эритроцита. Эта молекула была внимательно изучена Маршеси и его коллегами, сначала в Национальном Институте Здоровья и позднее в Йеле. Этот протеин также состоит из одной полипептидной цепи. Один из концов цепи, удерживающий углеводы, принадлежащие молекуле, преимущественно состоит из гидрофильных аминокислот; этот конец был подвергнут воздействию воды на внешней поверхности клеточной мембраны. Другой конец цепи, в состав которого также входят гидрофильные аминокислоты, увеличивается во влажной внутренней среде эритроцита. Середина цепи состоит из 30 аминокислот. Они практически полностью гидрофобны и находятся внутри двойного слоя липидов мембраны.
Поскольку все углеводы молекулы гликопротеина выходят за внешнюю поверхность мембраны эритроцита, мембрана имеет ассиметричную форму. К тому же, исследования маркировки, т.е. использования химических реагентов для маркировки «доступных» протеинов, показали, что ассиметрия мембраны эритроцитов выходит за рамки дисбаланса углеводов. Реагенты, которые не могут проникнуть через двойной слой липидов мембраны, маркируют два протеина в мембране цельного эритроцита. Первый является гликопротеином, второй – белком с молекулярным весом 87,000; только эти два белка расположены на внешней поверхности мембраны. Когда эритроцит лизируется и на нём образуется брешь для маркирующего реагента, все мембранные белки маркируются, демонстрируя, что большинство белков мембраны эритроцита расположены на её внешней поверхности.
Мембрана эритроцита является не единственным ассиметричным образованием. Техники маркировки показали, что внутренняя мембрана митохондрии устроена аналогичным образом. Молекулы протеина известные как «бородка», в действительности АТФ, всецело расположены в межклеточном веществе, или во внутренней части мембраны….
Данный документ в формате PDF Вы сможете найти и скачать на данной странице


Уведомление: HoT NeWs » что такое протеин